
CienciaAnunciaron resultados positivos de la vacuna contra el virus que provoca la bronquiolitis en recién nacidos
1 noviembre, 2022
Pfizer anunció los resultados de los estudios de Fase III de la inmunización materna contra el virus sincicial respiratorio, con una eficacia del 81,8% contra la enfermedad grave, en bebés de hasta 90 días de vida
El virus sincicial respiratorio (VSR) es altamente contagioso y una causa común de enfermedades respiratorias que puede ser potencialmente mortal en los bebés más pequeños, en personas con algunas afecciones crónicas y adultos mayores. Una de las enfermedades más habituales que provoca es la bronquiolitis, que es la principal causa de hospitalización infantil.
En la actualidad no existe un tratamiento específico para el VSR, solo medidas de atención de apoyo como oxígeno y líquidos y tampoco hay una vacuna para prevenirlo. El único agente preventivo disponible se recomienda para su uso en entornos limitados en los bebés de mayor riesgo como una inyección mensual con 5 dosis administradas durante la temporada de VSR, dejando a la mayoría de los bebés sin protección.
Pfizer es la única empresa que está investigando una vacuna y que está preparándola para aplicaciones reglamentarias tanto para bebés a través de la inmunización materna como para adultos mayores para ayudar a protegerse contra el VSR. Si se aprueba, podría ser la primera vacuna materna disponible para prevenir esta enfermedad respiratoria común. Vale destacar que el ensayo de Fase III también se realizó en la Argentina.
 La vacuna candidata RSVpreF contra el VSR en investigación por parte de Pfizer se basa en descubrimientos científicos básicos fundamentales, incluidos los realizados en los Institutos Nacionales de Salud de Estados Unidos
La vacuna candidata RSVpreF contra el VSR en investigación por parte de Pfizer se basa en descubrimientos científicos básicos fundamentales, incluidos los realizados en los Institutos Nacionales de Salud de Estados UnidosEl laboratorio anunció hoy que obtuvo “datos positivos de la primera línea del ensayo clínico de Fase III (NCT04424316) MATISSE ( estudio de inmunización MATernal para seguridad y eficacia) que investiga su candidata a vacuna de prefusión VSR bivalente, RSVpreF o PF-06928316, cuando se administra a participantes embarazadas para ayudar a proteger a sus bebés de la enfermedad por VSR después del nacimiento”.
Según datos brindados por los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés), sólo en Estados Unidos se producen aproximadamente 2,1 millones de visitas ambulatorias y 58.000 hospitalizaciones debido al VSR cada año entre niños menores de cinco años. En tanto, en todo el mundo, el VSR provoca la muerte de aproximadamente 102.000 niños al año, aproximadamente la mitad de ellos son menores de 6 meses y la gran mayoría en países en desarrollo, de acuerdo con información publicada en The Lancet.
“El análisis de eficacia provisional planificado previamente realizado por un Comité de Monitoreo de Datos (DMC) externo e independiente cumplió con el criterio de éxito para uno de los dos criterios de valoración principales. La eficacia observada para la enfermedad grave de las vías respiratorias inferiores con asistencia médica (MA-LRTI grave, por sus siglas en inglés) fue del 81,8% (IC: 40,6%, 96,3%) durante los primeros 90 días de vida. Se demostró una eficacia sustancial del 69,4% (IC: 44,3%, 84,1%) en lactantes durante el período de seguimiento de seis meses”, precisó el laboratorio.
 El ensayo evaluó la eficacia, la seguridad a lo largo del estudio y la inmunogenicidad de la vacuna en embarazadas y sus bebés
El ensayo evaluó la eficacia, la seguridad a lo largo del estudio y la inmunogenicidad de la vacuna en embarazadas y sus bebésLa vacuna experimental VSR fue bien tolerada, sin problemas de seguridad tanto para las personas vacunadas como para sus recién nacidos, y los resultados cumplieron con uno de los criterios de éxito regulatorio preespecificados del protocolo del estudio, dijo Pfizer por lo que planea presentar su primera solicitud regulatoria para fines de 2022
Pfizer en su comunicado agregó que, “aunque no se cumplió el criterio de éxito estadístico para el segundo criterio principal de valoración, se observó una eficacia clínicamente significativa para MA-LRTI (enfermedad grave de las vías respiratorias inferiores con atención médica) del 57,1% (IC: 14,7 %, 79,8 %) en lactantes desde el nacimiento hasta los primeros 90 días de vida. Se observó una eficacia para MA-LRTI del 51,3% (IC: 29,4%, 66,8%) durante el período de seguimiento de seis meses”.
“Estamos encantados con estos datos, ya que esta es la primera vacuna en investigación que se ha demostrado que ayuda a proteger a los recién nacidos contra enfermedades respiratorias graves relacionadas con el VSR inmediatamente después del nacimiento”, dijo Annaliesa Anderson, Ph.D., vicepresidenta senior y directora científica, de investigación y desarrollo de vacunas de Pfizer.
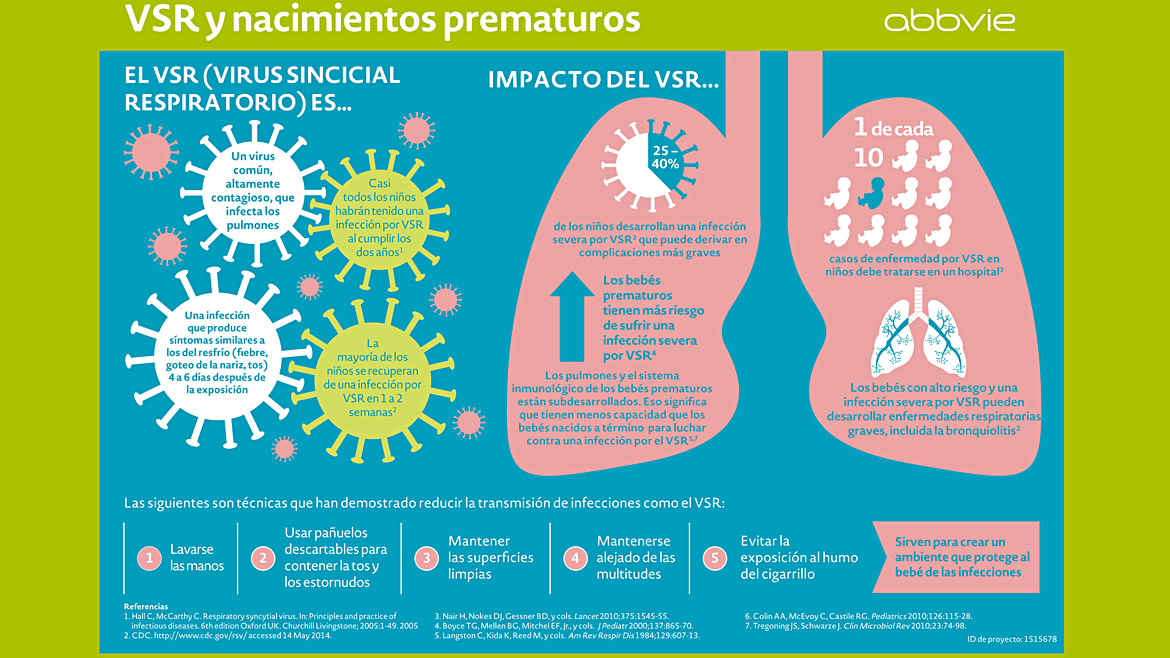 Cómo actúa el VSR y cómo evitarlo
Cómo actúa el VSR y cómo evitarlo“Estos datos refuerzan la determinación de Pfizer de aportar nuestra experiencia en la investigación y el desarrollo de vacunas innovadoras para abordar las necesidades críticas de salud pública utilizando nuevos enfoques y tecnologías. Esperamos trabajar con la FDA (Administración de Drogas y Alimentos de Estados Unidos) y otras agencias reguladoras para llevar esta vacuna candidata a las futuras madres para ayudar a proteger a sus bebés contra el VSR grave durante los primeros seis meses de vida más vulnerables, que tienen la mayor carga de enfermedad por VSR en los bebés”, agregó la directiva.
Por recomendación del DMC, y en consulta con la FDA, Pfizer suspendió la inscripción en el estudio. Con base en estos resultados positivos, Pfizer planea presentar una solicitud de licencia de productos biológicos (BLA) a la FDA para fines de 2022 para la vacuna candidata seguida por otras autoridades reguladoras en los próximos meses, reveló el laboratorio.
“Todos los años vemos altos niveles de casos de VSR entre bebés en Estados Unidos, y algunas regiones informaron tasas de hospitalización más altas de lo normal este año”, destacó Eric AF Simões, MD, profesor clínico de Pediatría y Enfermedades Infecciosas, de la Facultad de Medicina de la Universidad de Colorado y del Hospital de Niños de Colorado.
 El virus sincicial respiratorio (VSR) es altamente contagioso y una causa común de enfermedades respiratorias que puede ser potencialmente mortal en los bebés más pequeños
El virus sincicial respiratorio (VSR) es altamente contagioso y una causa común de enfermedades respiratorias que puede ser potencialmente mortal en los bebés más pequeños“Una vacuna materna con alta eficacia que puede ayudar a proteger a los bebés desde el nacimiento podría reducir sustancialmente la carga del VSR grave entre los recién nacidos hasta los seis meses de edad y, si las autoridades reguladoras la aprueban, probablemente tendrá un impacto significativo en la enfermedad en Estados Unidos y globalmente”, confió.
Pfizer explicó que MATISSE es un estudio de Fase III, aleatorizado, doble ciego, controlado con placebo, que se encuentra en curso, diseñado para evaluar la eficacia, la seguridad y la inmunogenicidad de RSVpreF frente a la enfermedad de las vías respiratorias inferiores con atención médica (MA-LRTI) y MA-LRTI grave en bebés nacidos de madres sanas, mujeres vacunadas durante el embarazo.
El estudio inscribió a aproximadamente 7.400 personas embarazadas. Las participantes maternas ≤ 49 años de edad fueron aleatorizadas en una proporción de 1:1 para recibir una dosis única de 120 µg de RSVpreF de Pfizer o un placebo durante el segundo o tercer trimestre de su embarazo. El ensayo también evaluó la seguridad a lo largo del estudio y la inmunogenicidad de la vacuna en embarazadas y sus bebés. Las participantes maternas fueron seguidas por seguridad a través de la vacunación y durante seis meses después del parto. Los lactantes fueron seguidos durante al menos un año en cuanto a seguridad y eficacia, y más de la mitad de los lactantes fueron seguidos durante dos años. Este fue un estudio global en 18 países, entre ellos la Argentina, y comenzó en junio de 2020, por lo que abarcó múltiples temporadas de VSR, tanto en el hemisferio norte como en el sur.
 En la actualidad no existe un tratamiento específico para el VSR, solo medidas de atención de apoyo como oxígeno y líquidos y tampoco hay una vacuna para prevenirlo
En la actualidad no existe un tratamiento específico para el VSR, solo medidas de atención de apoyo como oxígeno y líquidos y tampoco hay una vacuna para prevenirloPfizer aseguró que tiene la intención de enviar estos resultados para revisión por pares en una revista científica. El 2 de marzo de 2022, Pfizer anunció que su candidata a vacuna recibió la Designación de Terapia Innovadora de la FDA para la prevención de la enfermedad del tracto respiratorio inferior asociada con el VSR en bebés de hasta seis meses de edad mediante la inmunización activa de mujeres embarazadas.
La vacuna candidata RSVpreF contra el VSR en investigación por parte de Pfizer se basa en descubrimientos científicos básicos fundamentales, incluidos los realizados en los Institutos Nacionales de Salud de Estados Unidos (NIH, por sus siglas en inglés), que detallaron la estructura cristalina de la prefusión F, una forma clave de la proteína de fusión viral (F) que el VSR utiliza para entrar en las células humanas.
La investigación de los NIH mostró que los anticuerpos específicos de la forma de prefusión fueron altamente efectivos para bloquear la infección por el virus, lo que sugiere que una vacuna basada en prefusión F puede conferir una protección óptima contra el RSV. Después de este importante descubrimiento, Pfizer probó numerosas versiones de una proteína F de prefusión estabilizada e identificó un candidato que provocó una fuerte respuesta inmune antiviral en las evaluaciones preclínicas. La vacuna candidata bivalente está compuesta por cantidades iguales de prefusión F de VSR recombinante de los subgrupos A y B.
 El inmunizante contra el virus sincicial respiratorio del mismo laboratorio tuvo una alta eficacia, calculada en el 85,7% en Fase III en personas de 60 años o más
El inmunizante contra el virus sincicial respiratorio del mismo laboratorio tuvo una alta eficacia, calculada en el 85,7% en Fase III en personas de 60 años o másLa vacuna para adultos mayores
Pfizer anunció en agosto pasado que su vacuna contra el VSR, el responsable de la bronquiolitis, logró una eficacia del 85,7%. Esta cifra es el resultado de un análisis preliminar del estudio de Fase III, destinado a mayores de 60 años, que cuenta con más de 8 mil voluntarios en la Argentina.
El laboratorio dio cuenta de los “resultados positivos de primera línea de un análisis intermedio para RENOIR (estudio de eficacia de la vacuna VSR en adultos mayores inmunizados contra Renfermedad de SV), un ensayo clínico de Fase III (NCT05035212) que evalúa la eficacia, la inmunogenicidad y la seguridad de una dosis única de RSVpreF, en adultos de 60 años o más. Este estudio se inició en septiembre de 2021 y sigue en curso. RENOIR y MATISSE evaluaron las IVRI (infecciones de las vías respiratorias inferiores) graves de manera diferente entre las distintas poblaciones de estudio de adultos mayores y bebés, respectivamente”.
En marzo de 2022, Pfizer anunció que RSVpreF recibió la Designación de Terapia Innovadora de la Administración de Drogas y Alimentos de los EE. UU. (FDA) para la prevención de la enfermedad del tracto respiratorio inferior asociada con el VSR causada por el VSR en personas de 60 años o más. La designación de la FDA se basó principalmente en los resultados positivos de un estudio de Fase II de prueba de concepto que evaluó la seguridad, la inmunogenicidad y la eficacia de una dosis única de 120 µg de RSVpreF en un modelo de desafío viral humano en adultos sanos de 18 a 50 años. de edad.
 El estudio que involucró a adultos mayores lleva el nombre de RENOIR y el laboratorio ya dio cuenta de que su Fase III arrojó resultados positivos
El estudio que involucró a adultos mayores lleva el nombre de RENOIR y el laboratorio ya dio cuenta de que su Fase III arrojó resultados positivos“Estos resultados son históricos porque es la primera vez que una vacuna contra el VSR no sólo demuestra ser eficaz, que sería un valor por arriba del 40%, sino que además lo demuestra en un nivel altísimo, casi el 86%”, afirmó a Infobae en agosto último el médico pediatra Gonzalo Pérez Marc (MN 110.813), investigador principal del estudio que se desarrolla en el Hospital Militar. En ese sentido, recordó que esta inmunización se encuentra en estudio desde finales de los años 60 y que, con estas cifras, se trata “realmente un hito dentro de la investigación de vacunas de virus respiratorios”.
Incluso, al detallar el ensayo realizado en embarazadas, el experto señaló que el evaluado es el bebé. “Además del Hospital Militar, en la Ciudad de Buenos Aires, lo hicimos en diferentes provincias y centros. La idea fue tener una población variada de la República Argentina, que permite no solo saber si estas vacunas son eficaces sino su comportamiento en nuestra población”, agregó Pérez Marc; y completó: “Acá uno sigue a la mamá cuando está vacunada y, una vez que nace, se sigue al hijo o a la hija durante un año. Esto es algo realmente muy relevante, que cambiaría la historia de pediatría”.
FUENTE:INFOBAE



